超音波透熱治療儀臨床前測試基準
107 年 2 月 5 日 TFDA 公告「超音波透熱治療儀」臨床前測試基準(FDA 器字第 1061609714 號)以提供廠商作為產品研發及申請查驗登記資料準備之參考,台美檢驗為您整理重點如下:
適用範圍
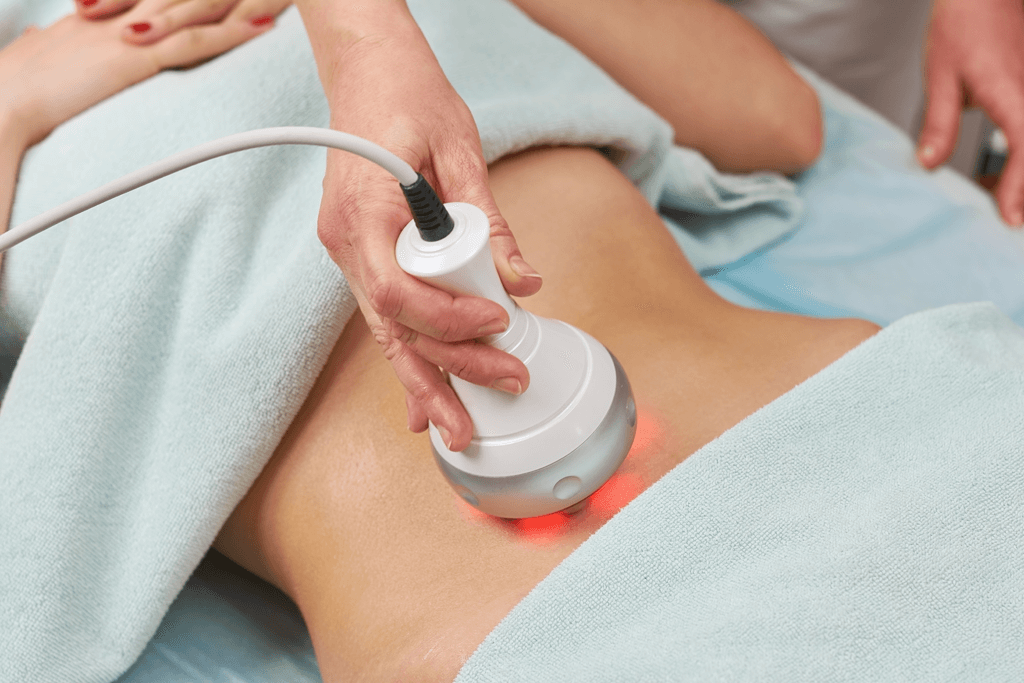
公告品項: O.5300 超音波透熱治療儀 (Ultrasonic diathermy)
鑑 別: (a) 特定醫療狀況需深層熱療所使用的超音波透熱治療儀,鑑別:特定醫療狀況需深層熱療所使用的超音波透熱法,是一種對身體特定部位施以頻率 20 KHZ 以上的超音波能量,來產生組織內深層熱之方法,用來治療特定狀況如減輕疼痛,解除肌肉痙攣及關節攣縮之器材,此器材不能用於治療癌症;分級:第二級。
不適用範圍
如有特定的適應症或其他的預期用途,則不在本基準適用範圍內。
安全性及功能性試驗
- 電性安全試驗 (Electrical Safety test)
- 電磁相容性試驗 (Electromagnetic compatibility test)
- 軟體確效 (Software Validation)
- 生物相容性試驗 (Biocompatibility test) :產品與人體接觸部位建議進行下列試驗:
細胞毒性 (Cytotoxicity)
過敏試驗 (Sensitization)
刺激 (Irritation) 或皮內刺激試驗 (Intracutaneous reactivity)
- 功能性試驗 (Performance test)
如製造廠未進行表列測試項目,應檢附相關文獻或科學性評估報告,以證實產品仍具有相等之安全及功能。
台美檢驗提供之試驗及測試服務
依據醫療器材相關規範及指引,台美檢驗可提供生物相容性等試驗服務,歡迎線上或來電洽詢。

你必須登入才能發表留言。