
農藥理化性及毒理試驗準則
廠商申請新農藥,需繳交各項理化性試驗、毒理試驗及田間試驗等資料,以進行審查,農委會於 2018 年 5 月 10 日預告修正「農藥理化性及毒理試驗準則」第三條附件二,配合農藥管理法 第十六條第三項,新增核准登記屆滿十五年之農藥申請許可證展延時,應重新檢附毒理試驗資料,但申請登記時已檢附者,無須再次重複提供,整理本次修正重點如下,供業者申請新藥時更全面掌握各項規範及準則。
提醒,2018 年 7 月 1 日起有關農藥登記之安全評估資料性採全面 GLP 登錄制,各項試驗(物化、毒理)報告需附試驗單位 GLP 實驗室登錄證明文件。
修正重點 再整理版
附表一至附表五:
- 增列「登記滿 15 年之農藥有效成分申請許可證展延」欄位,將原「已核准登記」欄之內容移至「相同有效成分、劑型、含量及使用範圍之農藥申請核發許可證」之欄位下。
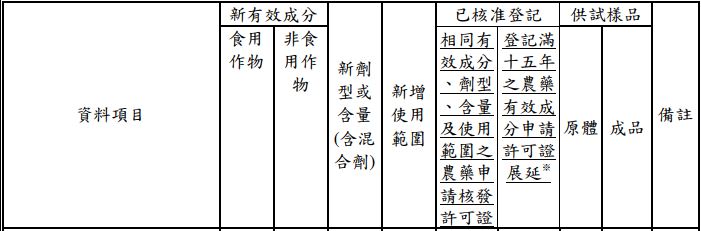
- 呈第 1 點,補充說明應檢附之資料內容,除提供毒理試驗資料外,也接受國際毒理權威組織或先進國家之毒理與環境風險評估報告。
- 呈第 1 點,並於相關備註中增列農藥有效成分屬特定時間以後登記者,無須再提供該項次資料之規定→「登記滿 15 年之農藥有效成分申請許可證展延時,應繳交本項試驗資料,試驗時以原體為供試樣品;但已於核准登記時檢附或於七十六年十一月六日以後登記者,免繳交本項試驗資料」。
附表一 & 附表四:
- 依據 OECD 化學品測試指引,修正致變異性試驗中部分試驗之英文名稱。
- 增列進行哺乳動物細胞遺傳學體內試驗之試驗選項→「哺乳動物精原細胞染色體畸變試驗」選項。
| 修正試驗名稱 | 現行試驗名稱 |
|---|---|
| 致變異性試驗 (Mutagenicity testing) | 致變異性試驗 (Mutagenicity testing) |
| 細菌基因逆向變異試驗 (Bacterial reverse mutation test) | 細菌基因逆向變異試驗 (Bacterial reverse gene mutation assay) |
| 哺乳動物細胞染色體 體外試驗 (In vitro mammalian cell assays) | 哺乳動物細胞染色體 體外試驗 (In vitro mammalian cell assay) |
| 哺乳動物細胞遺傳學 體內試驗 (In vivo cytogenetic assays) | 哺乳動物細胞遺傳學 體內試驗 (In vivo cytogenetics) |
附表一:
- 增列狗為試驗動物進行 90 日餵食毒性之試驗資料,如在亞慢性毒性試驗中已繳交以狗為試驗動物之 90 日餵食毒性資料者,則可免繳交為期一年之狗長期餵食毒性試驗。
- 新增試驗動物種類之選擇建議,以便業者選擇適當動物進行「生殖毒性」、「出生前發育毒性」及「動物體代謝」試驗。
- 修正應進行水生物生活週期性試驗之階層式管制要求說明,並增列進行該試驗之試驗選項。
附表一 & 附表二:增列對蜜蜂毒性之成品田間試驗報告之選項、修正備註中之粉源植物種類。
附表五:修正費洛蒙農藥毒理試驗項目中之致變異性試驗資料項目。
延伸閱讀:官方版 總說明及對照表
修正沿革歷史
- 2004 年 9 月 30 日農委會 農授防字第 0931484485 號令訂定發布全文 6條;並自發布日施行。
- 2008 年 7 月 23 日農委會 農授防字第 0971484482 號令修正發布名稱及全文 6 條;並自發布日施行(原名稱:農藥毒理試驗準則)。
- 2013 年 11 月 8 日農委會 農授防字第 1021487724 號令修正發布第 3 條附件 1、附件 2;並自發布日施行。
- 2017 年 3 月 17 日農委會 農授防字第 1061488169 號令修正發布第 3 條附件 1;並自發布日施行。
申請新農藥的流程
- 有關新農藥之申請流程,可參考農業藥物毒物試驗所整理資訊(點擊前往)
- 生物農藥登記申請流程,可參考農業藥物毒物試驗所整理資訊(點擊前往)
- 農藥登記線上申辦系統作業(點擊前往)
- 通過認可農藥田間試驗單位一覽表(點擊前往)
台美檢驗 農藥毒理試驗服務
台美檢驗 (SuperLab) 擁有 GLP 實驗室配置完善儀器設備,取得 TAF OECD GLP(財團法人全國認證基金會)與 TFDA GLP(衛生福利部食品藥物管理署)雙重認證,並具有「致變異性試驗」、「水域與陸生物之環境毒性試驗」、「生物降解性試驗」 等類別之 TAF OECD GLP 認證,可執行各項毒理試驗項目,歡迎來電或線上洽詢。

你必須登入才能發表留言。